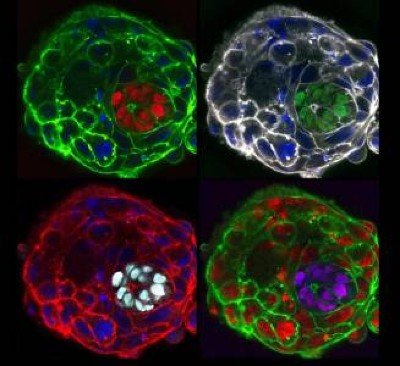
السعي لإنجاب أطفال باستخدام البويضات والحيوانات المنوية المزروعة في المختبر

Illustration: Barbara Gibson; Science Photo Library
خارج ردهة هادئة في الطابق العلوي من مبنى في جامعة أوساكا في اليابان، يقف كاتسوهيكو هاياشي. فقس ثورة.
علم الأجنة البشرية: هل يستطيع المنظمون في العالم مواكبة ذلك؟
إنه في سعي دام عقودًا لتحقيق ذلك زراعة البويضات والحيوانات المنوية في المختبر. يريد هاياشي أن يفهم البيولوجيا الأساسية لهذه الخلايا الإنجابية. لكن إذا نجح، فقد يتغير الأمر إلى الأبد كيف يتكاثر البشر.
وحتى بالنسبة لعالم معروف بإصراره الشديد، فقد كان الطريق ملتويًا. لقد أخذ هاياشي إلى بعض الأماكن الغريبة: مختبره ينمو شظايا من المبيضين الزائفين والخصيتين في الأطباق وأنتجت الفئران مع أبوين وليس أم1.
كل ورقة ينشرها تأتي برسائل بريد إلكتروني من أشخاص يطالبون بها المساعدة في خصوبتهم. يقول هاياشي: “أقول لهم: هذا لا يزال تجريبيًا”. “لكن في بعض الأحيان، لا أستطيع الرد. هناك الكثير”.
إن العمل الذي يقوم به هاياشي وآخرون في هذا المجال يمكن أن يوفر أملًا جديدًا للأشخاص الذين يعانون من العقم، وللأزواج من نفس الجنس الذين يريدون أطفالًا مرتبطين وراثيًا بكلا الشريكين. ولكن على الرغم من النتائج المبهرة التي حققها الباحثون على القوارض، إلا أن هذا المستقبل لا يزال بعيدًا. يقول كريستيان كرامي، كبير المسؤولين العلميين في شركة جاميتو، وهي شركة للتكنولوجيا الحيوية تركز على الخصوبة في أوستن، تكساس: “إن هذه التكنولوجيا رائعة للغاية”. “لكن بشكل أساسي، لا أعتقد أن هناك شخصًا واحدًا في العالم يجب أن يحاول تفعيل هذا سريريًا في العقد المقبل.”
ومع ذلك، هناك الكثير من الأهداف المؤقتة التي يتعين على الباحثين ملاحقتها. تأمل شركات الأدوية والجهات التنظيمية أن يؤدي الإمداد الوفير من الأمشاج البشرية – وهو المصطلح الشامل لخلايا البويضات والحيوانات المنوية – إلى تسهيل اختبار ما إذا كانت الأدوية والمركبات الأخرى يمكن أن تقلل الخصوبة، أو تسبب طفرات يمكن أن تنتقل إلى الجيل التالي، حسبما تقول إينا دوبرينسكي، عالمة الأحياء الإنجابية بجامعة كالجاري في كندا.
ويقول عظيم صوراني، عالم الأحياء التنموي بجامعة كامبريدج بالمملكة المتحدة، إن تعلم كيفية تلخيص التطور البشري في المختبر يمكن أن يكشف عن أدلة حول العقم. ويقول: “ستكون هذه هي النتيجة الأعظم لهذه الدراسات”. “بمجرد أن تفهم أسباب العقم، قد تجد طرقًا للتغلب عليها.”
ولكن مع تقدم المختبرات في هذه التجارب، يثير بعض الباحثين مخاوف بشأن الاستخدامات المستقبلية المحتملة لهذه التكنولوجيا. إن تزايد أعداد كبيرة من الأمشاج في المختبر يمكن أن يسهل على الآباء اختيار الأجنة للصفات المرغوبة، بل ويسهل أيضًا توليد أطفال معدلين وراثيًا.
على الرغم من أن مثل هذه الاستخدامات لا تزال بعيدة، حسب بعض التقديرات، على الأقل 15 عامًا، إلا أن الباحثين وبعض الهيئات الحكومية يدعون إلى وضع لوائح تنظيمية لمعالجة المشكلات المحتملة المرتبطة بالبويضات والحيوانات المنوية المزروعة في المختبر – وهي عملية تُعرف باسم في المختبر تكوين الأمشاج (IVG).
يختلف الباحثون في تقديراتهم حول متى سيصبح IVG البشري حقيقة واقعة. أنتج مختبر هاياشي صغار فئران خصبة مما يسميه خلايا تشبه البيضة نمت في المختبر2. ويقول إن هناك فرصة لتصنيع معادلات بشرية لهذه الخلايا في المختبر خلال العامين المقبلين.
هذه الفئران لديها أبوين ذكرين بيولوجيا. وتم إنتاجها باستخدام بيض مصنوع من خلايا جلد الذكور.المصدر: كاتسوهيكو هاياشي، جامعة أوساكا
ويضيف أن هذا لا يعني أنها ستكون جاهزة للاستخدام مع البشر. فقط نسبة صغيرة من أجنة الفئران التي تم توليدها من خلاياها الشبيهة بالبيض تؤدي إلى ظهور صغار حية، ويتوقع هاياشي أن الأمر قد يستغرق خمس سنوات أو أكثر لإنتاج بويضات بشرية فعالة حقًا بمعدلات نجاح مقبولة.
سيحتاج العلماء أيضًا إلى تطوير واختبار أمشاج الرئيسيات غير البشرية. من الناحية المثالية، سيتم تتبع النسل الناتج من هذه البويضات والحيوانات المنوية لعدة أجيال، مما يضيف سنوات إلى الجدول الزمني. يقول ميتينوري سايتو، عالِم الأحياء التطورية بجامعة كيوتو باليابان: “إنها نقطة حرجة”. “أعتقد أنه ربما سيتعين علينا الاعتماد على جيلنا القادم من العلماء لتحقيق هذا الهدف.”
وصفة للأمشاج
منذ ما يقرب من 20 عامًا، عرف الباحثون كيفية إعادة برمجة الخلايا في الجسم البشري إلى خلايا جذعية مستحثة متعددة القدرات (iPS)، والتي يمكن أن تأخذ أي هوية خلوية تقريبًا. وقد تم استخدام مثل هذه الخلايا لصنع خلايا قلبية تنبض في انسجام تام، وخلايا عصبية تقوم بتوصيل الإشارات الكهربائية. ولكن ثبت أن تلخيص التطور المعقد والطويل للحيوانات المنوية والبويضات هو أكثر صعوبة. يقول الصوراني: “هناك العديد من المراحل المعنية”. “وكل واحدة من هذه معقدة للغاية.”
عادة، يبدأ تكوين الأمشاج قبل الولادة بوقت طويل. يبدأ تطور البويضات في الجنين، حيث يتم إنتاج البويضات غير الناضجة بالملايين. تبدأ بعض هذه الخلايا بعد ذلك شكلًا متخصصًا من الانقسام، يسمى الانقسام الاختزالي، حيث تفقد مجموعة من الكروموسومات، وتحتفظ كل خلية بنصف عدد الخلية العادية. لكن هذا الانقسام يستغرق سنوات حتى يكتمل: تتوقف الخلايا في منتصف الانقسام الاختزالي ولن تستأنف إلا بعد سنوات، بعد البلوغ، عندما تتم الإباضة. كل بويضة غير ناضجة محاطة بنسيج يشكل جريبًا مملوءًا بالسوائل. تفرز هذه الجريبات الهرمونات وتنضج مع تطور البويضة.
وفي الوقت نفسه، تتشكل الخلايا التي تنتج الحيوانات المنوية أيضًا في الجنين، وبعد البلوغ، يمكنها إنتاج ملايين الحيوانات المنوية يوميًا في الأنابيب المنوية المتعرجة في الخصية. إن بيئتها الأنبوبية أكثر تعقيدًا من بصيلات المبيض، ويصعب على العلماء تلخيصها في المختبر.
في كلتا الحالتين، تعد بيئة البويضة أو الحيوان المنوي النامية أمرًا بالغ الأهمية. تتواصل الخلايا مع محيطها من خلال البروتينات والجزيئات الأخرى، وتتلقى إشارات فيزيائية من بيئتها التي تؤثر على نموها.
يبدو أن الحيوانات المنوية غير الناضجة تستجيب لتدفق السائل حولها أثناء تحركها عبر أنابيب الخصية، كما يقول هاياشي. وتقول إيفلين تيلفر، عالمة الأحياء الإنجابية بجامعة إدنبرة بالمملكة المتحدة، إن تصلب أنسجة المبيض يساعد على إبقاء البويضة النامية في حالة توقف.
اختبارات الأجنة المثيرة للجدل التي تعد بطفل أفضل
من الصعب تكرار هذه الإشارات والسقالات في المختبر، وخاصةً في عمليات IVG البشرية، لأنه من الصعب جدًا الحصول على أنسجة لدراسة التطور الطبيعي للمبيضين والخصيتين. يستخدم الباحثون تقنيات تسمح لهم بمراقبة نشاط الجينات وتعبير البروتين في الخلايا الفردية والأنسجة السليمة، لتحديد الجزيئات وأنواع الخلايا التي قد تكون مهمة، كما يقول تشوفا دي سوزا لوبيز، عالم الأحياء التنموي في المركز الطبي بجامعة ليدن في هولندا.
تقوم بعض الدراسات باحتضان الخلايا البشرية باستخدام خلايا المبيض أو الخصية لدى الفأر لتشجيعها على التطور إلى بويضات وحيوانات منوية3. ولكن لا يمكن استخدام هذا النهج في تصنيع الأمشاج لاستخدامها في التكاثر البشري بسبب احتمال تلوثها بالفيروسات الحيوانية.
في جامعة كولومبيا البريطانية في فانكوفر، كندا، قام طبيب المسالك البولية رايان فلانيجان وزملاؤه بطباعة أنابيب خصية ثلاثية الأبعاد من الخلايا البشرية لإجراء تجارب IVG4. وتشمل الأساليب الأخرى استخدام أجهزة ميكروفلويديك مصممة لتقليد الأعضاء. يقوم مختبر دوبرينسكي بزراعة مزارع خلايا ثلاثية الأبعاد تسمى العضيات، والتي تجمع بين عدة أنواع من الخلايا الموجودة في الخصية.
لا تزال هناك مكامن الخلل للعمل بها. على سبيل المثال، يكافح فريق دوبرينسكي للحفاظ على الكائنات العضوية حية لفترة كافية لتنمية الأمشاج البشرية. في البشر، يستغرق تطور البويضات والحيوانات المنوية أشهرًا3يقول كوتارو ساساكي، عالم الأحياء الإنجابية بجامعة بنسلفانيا في فيلادلفيا، دون احتساب سنوات الانتظار الطويلة حتى البلوغ. يقول: “كثير من الناس لا يعرفون مدى صعوبة الأمر”.
الأمشاج في حالة تأهب
يقول إيشي أيزاوا، عالم الأحياء التنموي بجامعة هارفارد في كامبريدج، ماساتشوستس، إن هذا الوقت الطويل في الثقافة لا يؤدي إلى إبطاء الأبحاث فحسب، بل يمكن أيضًا أن يزيد من خطر حدوث خطأ ما، مما قد يعرض صحة المنتج النهائي وأي ذرية للخطر.
تحاول بعض المجموعات جعل العملية أكثر كفاءة. على سبيل المثال، اكتشف أحد الفرق مؤخرًا ثلاثة بروتينات يبدو كل منها قادرًا على بدء الانقسام الاختزالي في الخلايا الجذعية المحفزة متعددة القدرات الذكرية والأنثوية5.
لكن بعض سمات هذا الانقسام الاختزالي غير عادية، ولا تكمل الخلايا انقسامها، كما يقول عضو الفريق ميريك بيرسون سميلا، كبير المسؤولين العلميين في شركة Ovelle، وهي شركة للتكنولوجيا الحيوية في بوسطن، ماساتشوستس.
تقول باولا كوهين، عالمة الأحياء الخلوية في كلية الطب البيطري بجامعة كورنيل في إيثاكا، نيويورك، إن الانقسام الاختزالي هو نقطة عثرة رئيسية في عملية IVG. لقد حاولت هي ومعاونوها حث الأمشاج البشرية غير الناضجة على الخضوع للانقسام الاختزالي الطبيعي لمدة عقد تقريبًا. “إنها لا تعمل” ، كما تقول. يقول كوهين إن العديد من الفرق التي أعلنت عن نجاحها لم تثبت بشكل كامل أن الانقسام الاختزالي يحدث في أطباق بتري الخاصة بهم كما يحدث في الجسم. والانقسام الاختزالي الصحيح مهم: الأخطاء في العملية يمكن أن تؤدي إلى أمشاج تحتوي على عدد خاطئ من الكروموسومات.
نهج مختلف، ذكرت الشهر الماضي6يبدو أنها تنتج بويضات وظيفية قادرة على التخصيب. استبدل الباحثون نواة خلية البويضة غير الناضجة، التي تحتوي على نسخة واحدة من كل كروموسوم، بنواة من خلية جلدية تحتوي على نسختين من كل منهما. ثم أطلقوا عملية أطلقوا عليها اسم الانقسام الاختزالي، والتي تخلصت من مجموعة واحدة من الكروموسومات، ومحاكاة بعض سمات الانقسام الاختزالي.
أدى حوالي 9% من هذه الخلايا إلى إنتاج بويضات قابلة للحياة تم تخصيبها وتطويرها لمدة ستة أيام أخرى، مما أدى إلى توليد مقدمة لجنين يعرف باسم الكيسة الأريمية. لكن جميع الكيسات الأريمية كانت تعاني من تشوهات صبغية، ولم تخضع للخلط الجيني الذي يحدث عادة أثناء تطور الأمشاج. تعتبر إعادة التركيب هذه مصدرًا للتنوع الجيني، ومن غير الواضح كيف سيؤثر نقصها على النسل، كما يقول كوهين، أو كيف تؤثر عملية الانقسام الخيطي على انقسامات الخلايا اللاحقة. “هذا سيحتاج إلى دراسة مكثفة.”
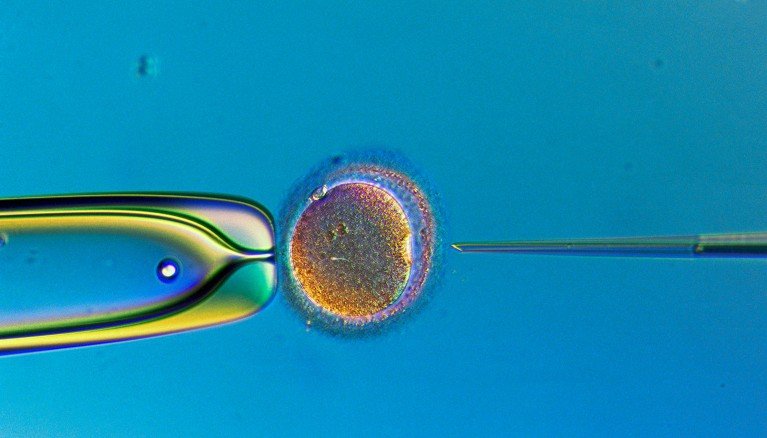
يمكن استخدام الأمشاج المزروعة في المختبر يومًا ما في المختبر الإخصاب.مصدر الصورة: لينارت نيلسون، تي تي/مكتبة الصور العلمية
هناك عقبة أخرى أمام تحقيق IVG البشري وهي إعادة إنشاء التسلسل المعقد لتغيرات الحمض النووي التي تحدث في مراحل مختلفة من التطور. في وقت مبكر من تكوين الأمشاج، تقوم الخلايا بشكل منهجي بمحو بعض التعديلات الكيميائية التي يمكن أن تؤثر على نشاط الجينات؛ وفي وقت لاحق، تتم إضافة تعديلات جديدة على مناطق معينة من الحمض النووي، ويقال بعد ذلك أن بعضها “مطبوع”.
تعتبر هذه الخطوة حاسمة: فقد تم ربط أكثر من اثني عشر اضطرابًا بالبصمة غير السليمة، كما يقول الصوراني. “عليك أن تحصل على هذا الحق”، كما يقول.
■ مصدر الخبر الأصلي
نشر لأول مرة على: www.nature.com
تاريخ النشر: 2025-10-15 03:00:00
الكاتب: Heidi Ledford
تنويه من موقع “yalebnan.org”:
تم جلب هذا المحتوى بشكل آلي من المصدر:
www.nature.com
بتاريخ: 2025-10-15 03:00:00.
الآراء والمعلومات الواردة في هذا المقال لا تعبر بالضرورة عن رأي موقع “yalebnan.org”، والمسؤولية الكاملة تقع على عاتق المصدر الأصلي.
ملاحظة: قد يتم استخدام الترجمة الآلية في بعض الأحيان لتوفير هذا المحتوى.