إصلاحها على وشك أن يصبح أسهل بكثير
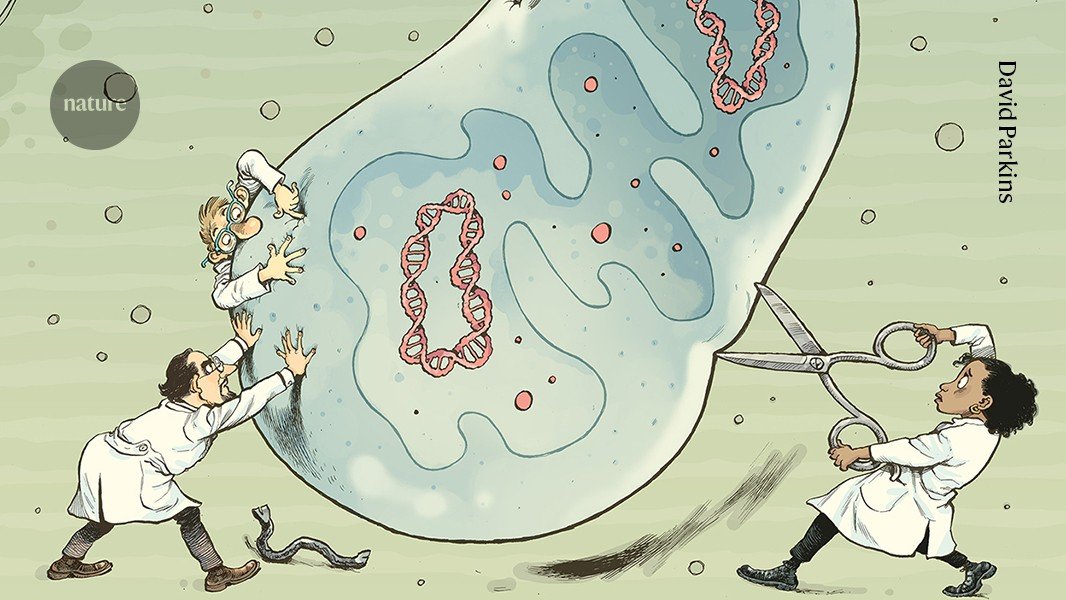
Illustration: David Parkins
لقد شق تحرير الجينات بتقنية كريسبر طريقه إلى كل ركن من أركان علم الأحياء الحديث، ولكن ليس إلى كل ركن من أركان الخلية. على الرغم من أن الباحثين قد استخدموا هذه الأنظمة لتطويرها علاجات فقر الدم المنجلي وسرطانات الدم لفتح أسرار تعدد الخلايا واكتشاف دور الآلاف من البروتينات التي تم التغاضي عنها، هناك مكان واحد لا يمكن لـ CRISPR الوصول إليه بسهولة: الميتوكوندريا.
تحصل الخلايا السرطانية على تعزيز الطاقة عن طريق سرقة الميتوكوندريا من الأعصاب
لا يمكن الوصول إلى حلقات الحمض النووي داخل الميتوكوندريا بهذه التقنيات، مما يعني أن التعديلات الدقيقة على الحمض النووي للميتوكوندريا (mtDNA) تظل بعيدة المنال بشكل محبط. يقول ميشال مينشوك، عالم الوراثة بجامعة كامبريدج بالمملكة المتحدة: «لقد فاتت الميتوكوندريا ثورة كريسبر-كاس9 التي انفجرت قبل 12 عامًا».
لكن الباحثين حريصون على الوصول إلى هذا الحمض النووي، كما يقول مينشوك. الميتوكوندريا هي عضيات على شكل حبة الفول خلايا الطاقة ولها عدد لا يحصى من المهام الخلوية الأخرى. يعد استكشاف الحمض النووي الخاص بهم أمرًا ضروريًا لفهم إنتاج الطاقة وتبادلها الذي تقوم عليه الصحة الأيضية. وهناك أكثر من 300 طفرة في هذا الحمض النووي تسبب أمراض الميتوكوندريا، وهي اضطرابات وراثية غير قابلة للشفاء مع مجموعة واسعة من الأعراض التي يمكن أن تحرم الأشخاص من بصرهم وسمعهم، وتؤدي إلى مشاكل في العضلات وتثير نوبات صرع.1. تؤثر هذه الاضطرابات على شخص واحد تقريبًا من كل 5000 شخص.
ولأن تقنية كريسبر لا يمكنها المساعدة في حل هذه المشكلات، فقد كان الباحثون يبحثون عن طرق أخرى لتعديل جينوم الميتوكوندريا بدقة. وقد حققت السنوات القليلة الماضية بعض النجاح: فقد أثبتت الأدوات بالفعل أنها نعمة لإنشاء نماذج حيوانية دقيقة لأمراض الميتوكوندريا. يقول جين سو كيم، عالِم الأحياء الكيميائية الذي يطوِّر أدوات تحرير الحمض النووي الميتوكوندري في المعهد الكوري المتقدم للعلوم والتكنولوجيا في دايجيون بكوريا الجنوبية: “لقد كان التقدم ملحوظًا”.
إذا تمكن الباحثون من جعل تحرير الحمض النووي الميتوكوندري آمنًا ودقيقًا بما فيه الكفاية، فيمكن استخدامه في النهاية لعلاج هذه الحالات الوراثية، وحتى علاجها. يقول كيم: “سيكون هذا إنجازًا طبيًا”.
أصل بكتيري
إن الأصول الدقيقة للميتوكوندريا غامضة، لكن النظرية الرائدة تؤكد ذلك بدأت قصة العضية منذ حوالي 1.5 مليار سنة، عندما التهم كائن حي مجهري وحيد الخلية يسمى العتائق بكتيريا متجولة ظلت على قيد الحياة داخل مضيفها. شهد هذا الحدث بداية حقيقيات النوى – مجموعة كبيرة من الكائنات الحية، بما في ذلك النباتات والحيوانات والفطريات، تحتوي خلاياها على عضيات محاطة بالأغشية. احتفظت البكتيريا المبتلعة بحمضها النووي الدائري المميز عندما استقرت في موطنها الجديد، لكنها مع مرور الوقت ضحت بمعظم جيناتها للجينوم النووي لمضيفها.
في السلالة التطورية التي أدت إلى ظهور البشر والحيوانات الأخرى، أدى هذا النقل الجيني إلى تقليص جينوم البكتيريا المقيمة إلى 37 جينًا فقط ترمز لـ 13 بروتينًا مشاركًا في إنتاج الطاقة، مما يحولها إلى عضية متخصصة.
تطرد الميتوكوندريا الحمض النووي الملوث، مما يؤدي إلى الالتهاب المرتبط بالعمر
تختلف الكمية الصغيرة من الحمض النووي للميتوكوندريا العالقة في الحيوانات في نواحٍ رئيسية عن الحمض النووي النووي، الذي يشفر حوالي 20 ألف جين في البشر. في البداية، عادة ما يتم توريث الحمض النووي للميتوكوندريا من الأم فقط. يمكن أن يكون هناك عدة نسخ من الحمض النووي للميتوكوندريا في كل ميتوكوندريا، والعضية لديها آليتها المدمجة الخاصة لصنع الحمض النووي الريبي (RNA) والبروتينات من هذا الحمض النووي.
كما أن الحمض النووي للميتوكوندريا أكثر عرضة للخطأ، حيث يقدر معدل الطفرة فيه بنحو 10 إلى 20 مرة أكبر من معدل الطفرة في الحمض النووي النووي. ويرجع ذلك جزئيًا إلى أنه يتعين عليها التعامل مع وابل من أنواع الأكسجين التفاعلية الضارة، وهي جزيئات غير مستقرة يتم توليدها في الميتوكوندريا أثناء إنتاج الطاقة الطبيعية. ولكن هذا أيضًا بسبب ذلك لا يحتوي على الهستونات: البروتينات التي تحمي وتعبئ الحمض النووي.
بالمقارنة مع نظيرتها في النواة، تعد مجموعة أدوات mtDNA لإصلاح نفسها بدائية. تعمل النواة بسرعة على إصلاح شريط الحمض النووي المقطوع باستخدام ترسانة من آليات الإصلاح، لكن الميتوكوندريا يمكنها إصلاح بعض العيوب فقط. غالبًا ما يتخلصون ببساطة من حمضهم النووي المكسور. يحد هذا الاختلاف من الخيارات المتاحة لأدوات تحرير الجينات، لأن جميع أدوات الحمض النووي النووي تقريبًا تستخدم مسارات الإصلاح المتأصلة فيها.
يقول ستيفن إيكر، عالِم الأحياء الجزيئية بجامعة تكساس في أوستن، إن تطوير طرق تعديل الحمض النووي للميتوكوندريا كان أمرًا صعبًا للغاية. ويقول: “يتم الكشف عن أصوله البكتيرية عندما تبدأ في محاولة تعديله”.
إن العقبة الأكثر أهمية أمام العلماء الذين يحاولون التلاعب بجينوم الميتوكوندريا هي أنها محصورة خلف جدار من الأغشية التي لا تسمح للأحماض النووية الخارجية بالمرور إلى العضية. على الرغم من وجود تلميحات لذلك أدوات تحرير الجينات المعتمدة على تقنية كريسبر – التي تعتمد على الحمض النووي الريبي (RNA) لتوجيهها إلى التسلسل الصحيح – قد تكون قادرة على التغلب على هذه العوائق، إلا أن العديد من الباحثين ما زالوا غير مقتنعين.
القصاصة والقمامة
ومع ذلك، لا تزال هناك طرق أخرى لتحقيق ذلك. فقبل أكثر من عقد من أن تصبح تقنية كريسبر أداة بحثية، بدأ باحثو الميتوكوندريا في تجربة أدوات تحرير أخرى يمكنها عبور أغشية الميتوكوندريا وإقناع العضيات بالدخول إليها. التخلص من الحمض النووي الإشكالي2.
تحتوي كل خلية على عدد كبير من جينومات الميتوكوندريا، لأن الخلايا تحتوي على آلاف الميتوكوندريا ويمكن لكل واحدة منها أن تحمل عدة نسخ من الحمض النووي للميتوكوندريا. غالبًا ما يتعايش الحمض النووي الميتوكوندري (mtDNA) السليم والمتحور: وهي حالة تُعرف باسم البلازما المتغايرة. عندما تصل نسبة الحمض النووي الميتوكوندري المتحور إلى 60-80% في نسيج أو نوع معين من الخلايا تظهر أمراض الميتوكوندريا3.
تقوم الخلايا بتبادل الميتوكوندريا الخاصة بها. ماذا يعني هذا بالنسبة لصحتنا؟
إذا تمكن الباحثون من تقليل النسخ المعيبة من الحمض النووي الميتوكوندري في الخلايا، فيمكنهم القضاء على المرض الناتج. لذلك، لجأوا إلى إنزيمات تسمى نوكلياز إصبع الزنك (ZFNs) ونواة المستجيب الشبيهة بمنشط النسخ (TALENs) لقص الحمض النووي الميتوكوندري المزدوج الذي تقطعت به السبل. في حين أن القص المستهدف للحمض النووي النووي يحث خيوط الحمض النووي المقطوع على لصق نفسها مرة أخرى دون حدوث طفرة ضارة، فإن الحمض النووي المقطوع في الميتوكوندريا يتم التخلص منه ببساطة. يؤدي هذا الحذف إلى تحفيز النسخ السليمة المتبقية لتكرار نفسها بحيث يتم الحفاظ على المستوى الصحيح من mtDNA.
في معظم الحالات، سيتم تقليل النسخ المتحورة إلى مستوى مقبول عندما يتم نسخ النسخ العادية. يقول كارلوس مورايس، عالم الوراثة بجامعة ميامي في فلوريدا: «هذا سيعوض ما تدمره».
وعلى الرغم من التقدم الذي تم إحرازه في هذا النهج، إلا أنه لم يخرج من المختبر. وحتى لو وصلت إلى العيادة، فإن هذه التقنية ستكون عاجزة ضد الأمراض الناجمة عن الطفرات التي غالبا ما تكون موجودة في جميع نسخ الحمض النووي الميتوكوندري للشخص، مثل اعتلال العصب البصري الوراثي لليبر (LHON)، وهي حالة نادرة تسبب فقدان البصر السريع.
ما يحتاجه الباحثون هو الأدوات التي تقوم بما هو أكثر من قطع الحمض النووي، ولكنها لا تعتمد على الحمض النووي الريبوزي الموجه.
تحرير قاعدة خالية من كريسبر
عندما ظهرت تقنية كريسبر-كاس9 كأداة في عام 2012، أصبحت الأداة الأولى انتقل إلى محرر الجينات لجميع أنواع التطبيق. يقوم الحمض النووي الريبوزي الموجه بتوجيه إنزيم Cas9 إلى تسلسل DNA محدد، حيث يقوم الإنزيم بالقطع. يتم إدخال التغييرات الجينية عندما يقوم الحمض النووي بإصلاح نفسه.
أصبح هذا النهج أكثر فائدة في عام 2016، عندما قدم ديفيد ليو، عالم الأحياء الكيميائية في معهد برود التابع لمعهد ماساتشوستس للتكنولوجيا وجامعة هارفارد في كامبريدج، ماساتشوستس، وزملاؤه تقنية أكثر دقة تسمى تحرير قاعدة4. في هذه الحالة، يقوم الباحثون بتعديل إنزيم Cas9 ويعتمدون على إنزيم آخر، يسمى دياميناز، لتحويل حرف أساسي من الحمض النووي إلى حرف آخر، مثل السيتوزين (C) إلى ثيمين (T) أو الأدينين (A) إلى جوانين (G).
الأمل واليأس وكريسبر – السباق لإنقاذ حياة امرأة واحدة
على الرغم من نجاح تحرير القواعد وتقنيات كريسبر الأخرى في الحمض النووي النووي، إلا أن ليو وفرق البحث الأخرى لم تتمكن من تشغيلها على الحمض النووي للميتوكوندريا. ونظرًا لأن الحمض النووي الريبوزي الدليلي الخاص بكريسبر لا يمر بسهولة عبر الغشاء المزدوج للميتوكوندريا، فإن استخدام أدوات دقيقة على الحمض النووي للميتوكوندريا ظل حلمًا بعيد المنال. يقول ليو: “لم نحقق الكثير من النجاح”.
تجسد الحل في عام 2018 عندما عثر جوزيف موجوس، عالم الأحياء الدقيقة الذي كان يعمل آنذاك في جامعة واشنطن في سياتل، وزملاؤه على مادة سامة تصنعها البكتيريا. بوركولديريا سينوسيباكيا. هذا الإنزيم، وهو سلاح فتاك ضد البكتيريا الأخرى، يسبب الفوضى عن طريق تحويل القاعدة C إلى T في نهاية المطاف عبر الجينوم البكتيري.5.
أرسل موجوس، الذي يعمل حاليًا في جامعة ييل في نيو هيفن بولاية كونيتيكت، رسالة بالبريد الإلكتروني إلى ليو يسأله فيها عما إذا كان الإنزيم المسمى DddA سيكون له أي فائدة بالنسبة له. “كنت أعرف بالضبط ما يمكن استخدامه من أجله – تحرير قاعدة mtDNA!” يقول ليو.
لكن تحويل كل C إلى T سيكون قاتلاً للخلايا. شرع ليو وزملاؤه في “ترويض الوحش”. لقد قاموا بتقسيم DddA إلى قطعتين غير نشطتين بحيث يقوم الإنزيم بعمله على mtDNA فقط عندما يتم جمع القطع معًا في اتجاه معين. وبدلاً من استخدام دليل الحمض النووي الريبوزي (RNA)، قام ليو وزملاؤه بتعديل البروتينات الموجودة في TALENs لتوجيه أجزاء DddA إلى تسلسلاتها المستهدفة (انظر: “إجراء التعديل”).
نشر لأول مرة على: www.nature.com
تاريخ النشر: 2025-10-14 03:00:00
الكاتب: Gemma Conroy
تنويه من موقع “yalebnan.org”:
تم جلب هذا المحتوى بشكل آلي من المصدر:
www.nature.com
بتاريخ: 2025-10-14 03:00:00.
الآراء والمعلومات الواردة في هذا المقال لا تعبر بالضرورة عن رأي موقع “yalebnan.org”، والمسؤولية الكاملة تقع على عاتق المصدر الأصلي.
ملاحظة: قد يتم استخدام الترجمة الآلية في بعض الأحيان لتوفير هذا المحتوى.