كيف أضاءت أجهزة الاستشعار المشفرة وراثيا علم الأعصاب

Neurons expressing the dopamine sensor dLight3.8. Credit: Erin Scott
في الجهاز العصبي، المشابك العصبية هي المكان الذي يحدث فيه الفعل. وهناك، عبر فجوة ضيقة بين الخلايا المتجاورة، تتحدث الخلايا العصبية مع بعضها البعض من خلال التبادل الديناميكي للإشارات الكيميائية والكهربائية. تعمل الجزيئات المعروفة باسم الناقلات العصبية والمعدلات العصبية على تحفيز أو تثبيط إمكانات الفعل – وهي ارتفاعات في الجهد عبر أغشية الخلايا العصبية التي تؤدي إلى إطلاق جزيئات أخرى. يتيح هذا الحديث المتبادل في نهاية المطاف إنتاج العواطف والأفكار والسلوكيات – كل ما يجعل الدماغ على ما هو عليه.
طريقة جديدة لالتقاط سيمفونية الدماغ الكهربائية
ولفك تشفير هذه المحادثات، اعتمد الباحثون على أدوات مختلفة. وتشمل هذه الفيزيولوجيا الكهربية، حيث يتم إدخال أقطاب كهربائية في الدماغ أو الخلايا الفردية (في حالة تسجيل المشبك التصحيحي) لقياس تغيرات الجهد المرتبطة بإمكانات الفعل؛ غسيل الكلى الدقيق، حيث يتم استخراج بعض السوائل المحيطة بالخلايا العصبية وتحليلها؛ وقياس الجهد الدوري سريع المسح، والذي يستخدم أقطاب كهربائية مزروعة للكشف عن جزيئات إشارة معينة.
لكن هذه الأساليب لها حدود. على سبيل المثال، يمكن للفيزيولوجيا الكهربية قياس إمكانات الفعل بدقة، لكن العلماء لا يستطيعون تحديد الناقلات العصبية أو المعدلات العصبية (التي تسمى مجتمعة بالمواد الكيميائية العصبية) التي تحركها. يمكن للتحليل الدقيق تحديد جزيئات معينة، لكنه يفتقر إلى الدقة المكانية والزمانية لتحديد متى وأين يتم إطلاق هذه المواد الكيميائية العصبية بدقة، وغالبًا ما يواجه قياس الجهد صعوبات في التمييز بين الجزيئات المتشابهة مع بعضها البعض.
لقد أتاح تطوير أجهزة الاستشعار المشفرة وراثيا على مدى العقدين الماضيين وسيلة لعلماء الأعصاب للتحايل على هذه القضايا. تم تطوير أجهزة الاستشعار هذه في البداية لتحديد إمكانات الفعل في الخلايا من خلال تتبع التغيرات في أيونات الكالسيوم، ولكن في السنوات الأخيرة، قام الباحثون بتوسيع صندوق الأدوات للكشف عن المواد الكيميائية العصبية الرئيسية.
الجيل القادم من هذه المستشعرات يمكّن العلماء الآن من طرح أسئلة مثل: ما هي كمية المادة الكيميائية العصبية المحددة التي يتم إطلاقها استجابةً لإطلاق إمكانات الفعل؟ ما عدد إمكانات الفعل المطلوبة لإطلاق مادة كيميائية عصبية معينة؟ وما المدة التي يظل فيها هذا الجزيء موجودًا؟ يقول نيكولاس تريتش، عالم الأعصاب في جامعة ماكجيل في مونتريال، كندا: “كل هذه الأنواع من الأسئلة، بالنسبة للغالبية العظمى من الجزيئات – نحن نتحدث عن الدوبامين، والسيروتونين، والأسيتيل كولين، والعديد من الجزيئات الأخرى – لا نعرف عنها شيئًا تقريبًا”. “هذه الفئة الجديدة من أجهزة الاستشعار المشفرة وراثيا فتحت هذا العالم حقا.”
اضاءة الخلايا
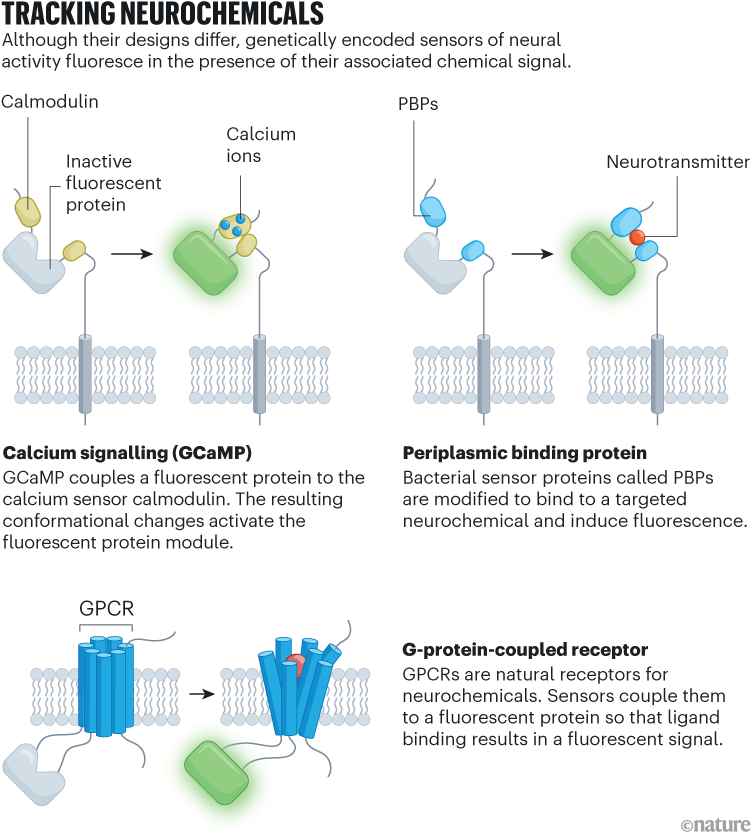
بدأت الثورة في الاستشعار الكيميائي العصبي المشفر وراثيا بالكالسيوم. تعمل جهود الفعل على تنشيط بروتينات القنوات المتخصصة على غشاء الخلية العصبية وتسمح للكالسيوم بالدخول وتغيير تركيز الكالسيوم. من خلال دمج بروتين الكالمودولين المرتبط بالكالسيوم مع بروتين الفلوريسنت واستهداف الجزيء الهجين وراثيًا لمجموعات محددة من الخلايا، طور الباحثون أجهزة استشعار تضيء استجابةً لتقلبات الكالسيوم، وهو بديل للنشاط العصبي.
هناك مجموعة شائعة من مؤشرات الكالسيوم المشفرة وراثيًا، والمعروفة باسم GCaMPs، موجودة منذ عام 2001. ومنذ ذلك الحين، قام الباحثون بتحسين سرعة وحساسية أجهزة الاستشعار – وهم الآن الركائز الأساسية لأبحاث علم الأعصاب. تقول لورين لوجر، عالمة الأعصاب بجامعة كاليفورنيا في سان دييجو (UCSD)، التي يعمل فريقها على تطوير هذه المستشعرات: “إنها منتشرة في كل مكان، لدرجة أن معظم الأوراق البحثية التي تستخدم GCaMPs توقفت عن الاستشهاد بالأبحاث ذات الصلة”.
توفر أجهزة الاستشعار المشفرة وراثيًا العديد من المزايا (انظر: “تتبع المواد الكيميائية العصبية”). يمكن للباحثين التعبير عنها في أوقات محددة في خلايا معينة، ثم إقرانها بتقنيات مثل علم البصريات الوراثي لجعلها تنشط استجابةً للضوء. ولكنها تتطلب أيضًا معالجة وراثية وقد تغير بيولوجيا الخلايا بطرق غير متوقعة.
المصادر: GCaMP: واي يانغ وآخرون. آن. ريف. شرجي. الكيمياء. 17، 367-392 (2024); بب و غبكر: ز.وو وآخرون. طبيعة القس. 23، 257-274 (2022)
ومع ذلك، فإن نجاح هذه المستشعرات حفز العديد من مطوري الأدوات، بما في ذلك لوجر، على ابتكار استراتيجيات مماثلة للكشف عن مواد كيميائية عصبية أخرى. من بينها الناقلات العصبية مثل الغلوتامات وحمض غاما أمينوبوتيريك (GABA) والأسيتيل كولين — التي تنشط الخلايا العصبية أو تمنعها — والمعدلات العصبية مثل الدوبامين والسيروتونين والإندوكانابينويدات، التي تحفز المسارات الجزيئية في الدماغ.1.
وفي عام 2018 ورقتان2,3 تم نشره بفارق أسابيع فقط من قبل فرق في الولايات المتحدة والصين بشكل مستقل، حيث وصف أجهزة الاستشعار المشابهة لـ GCaMP للدوبامين، وهو مُعدِّل عصبي يشارك في صنع القرار على أساس المكافأة، والتعلم والعديد من العمليات الأخرى.
يطلق عليها اسم dLight1 و GRAB-وعلى التوالي، تم بناء مستشعرات الفريقين على مستقبل الدوبامين، وهو أحد عائلة البروتينات المعروفة باسم المستقبلات المقترنة بالبروتين G (GPCRs). قامت الفرق، بقيادة عالم الأعصاب لين تيان، الذي كان يعمل آنذاك في جامعة كاليفورنيا، ديفيس، ويولونج لي، عالم الأعصاب في جامعة بكين في بكين، بتعديل المستقبل ليتألق في وجود الدوبامين، وأدخلوا هذا الجين في فيروس. يمكن للباحثين بعد ذلك حقن أجهزة الاستشعار في حيوان حي ومراقبة نشاط جزيئات معينة في الخلايا المصابة في الدماغ باستخدام قياس الألياف الضوئية، وهي تقنية تقيس التغيرات في التألق باستخدام ألياف بصرية مزروعة في الدماغ.
كيفية الحفاظ على الأضواء مضاءة: مهمة إنتاج المزيد من الفلورفورات القابلة للضوء
وسرعان ما أصبحت هذه المستشعرات من الإضافات الشائعة إلى مجموعة أدوات علم الأعصاب، وتم الاستشهاد بالأوراق البحثية أكثر من 800 مرة. ويقول مارك والتون، عالم الأعصاب بجامعة أكسفورد بالمملكة المتحدة، إن شعبية هذه الأجهزة ترجع جزئيًا إلى سهولة استخدامها. قد يكون من الصعب إتقان الأساليب التقليدية، ويقول إن قياس الجهد، على وجه الخصوص، “يعد نوعًا من الفن الأسود”. ولكن مع وجود أجهزة الاستشعار المشفرة وراثيا، “لم ننظر إلى الوراء أبدا”. من بين أمور أخرى، استخدمها والتون وفريقه للتحقيق في تقلبات الدوبامين في ما يقرب من 200 ألف اختبار على الفئران، مما كشف أنه، على عكس النتائج السابقة من الأساليب التقليدية، يمكن أن يحدث اتخاذ القرار على أساس المكافأة بشكل مستقل عن الدوبامين.4.
هناك فائدة أخرى لأجهزة الاستشعار المعتمدة على GPCR وهي قابليتها للتعميم، مع تصميم تم توسيعه الآن ليشمل مستقبلات الأسيتيل كولين والسيروتونين والإندوكانابينويدات. يقول ماثيو بانجهارت، عالم الأعصاب في جامعة كاليفورنيا سان دييغو: “لقد أحدثت مستشعرات الدوبامين الأولية تلك ومتغيراتها المُحسَّنة لاحقًا تحولًا”. “إنه سهل التنفيذ للغاية، ولا حدود للقدرة على تطبيق هذا النهج على أي GPCR محل اهتمام.”
تمكين الاكتشافات
بدأت هذه المستشعرات في تغيير فهمنا بشكل أساسي لكيفية عمل الناقلات العصبية والمعدلات العصبية. خذ الدوبامين، على سبيل المثال. على الرغم من أن العلماء يعرفون منذ فترة طويلة ما يفعله، إلا أن كيفية نقل المعلومات في الدماغ بالضبط ظلت لغزا.
بصفته باحثًا في مرحلة ما بعد الدكتوراه في جامعة براون في بروفيدنس، رود آيلاند، في أواخر عام 2010، أراد عارف حامد أن يفهم كيف يتقلب الدوبامين في الدماغ. كانت إحدى الفرضيات الرائدة في ذلك الوقت هي أنه عندما يتم تنشيط الخلايا العصبية الدوبامين، سيتم إطلاق المُعدِّل العصبي عبر الدماغ بشكل موحد. ولكن عندما استخدم حميد وزملاؤه مستشعر dLight لتتبع حركات الجزيء في الجسم المخطط لأدمغة الفئران – وهي المنطقة التي تحتوي على العديد من الخلايا العصبية المستجيبة للدوبامين – اكتشفوا بدلاً من ذلك أن المُعدِّل العصبي تم إطلاقه على شكل موجات5. يقول حامد، الذي يعمل الآن عالم أعصاب في جامعة مينيسوتا في مينيابوليس: “لقد صدمنا تمامًا”. “لقد تحدى حقا توقعاتنا.”
المصابيح الجينية تنير الدماغ
وقد وجد تريتش وفريقه أن الأسيتيل كولين ينتشر أيضًا على شكل موجات عبر الجسم المخطط. باستخدام التصوير ثنائي اللون في الفئران الحية باستخدام أجهزة استشعار تعتمد على GRAB-DA لكل من الأسيتيل كولين والدوبامين، أفاد الباحثون في عام 2023 أنه بدلاً من وجود تركيز أساسي ثابت للجزيئين، فإن مستوياتهما تتقلب مع حركيات أقل من الثانية.6. يقول تريتش: “لقد وجدنا بصمات الدوبامين والأسيتيل كولين على فترات زمنية أسرع بكثير مما كنا نعتقد أنه ممكن”. “خطوتنا التالية هي أن نرى كيف يؤثر ذلك على الدماغ في هذه الفترات الزمنية.”
وتكشف المستشعرات أيضًا عن أسرار مواد كيميائية عصبية مهمة أخرى. في عام 2021، استخدم فريق بقيادة باحثين في كاليفورنيا وكندا مستشعرًا يعتمد على GRAB لدراسة إشارات endocannabinoid في دماغ الفأر.7. وفي وقت سابق من هذا العام، استخدم فريق آخر جهاز استشعار GPCR، يسمى ntsLight1.1، الذي يستجيب للنيوروببتيد العصبي، الذي يشارك في سلوك التغذية. كان الهدف هو دراسة ما يدفع الفئران التي تتغذى على نظام غذائي عالي الدهون فقط إلى البدء في تجنب الأطعمة الغنية بالسعرات الحرارية8. من بين أمور أخرى، أشار هذا التحليل إلى انخفاض مستويات النيوروتنسين في منطقة الدماغ المرتبطة بإشارات الدوبامين كسبب محتمل.
ولا تظهر هذه المستشعرات واعدة في علم الأحياء العصبي الأساسي فحسب. على سبيل المثال، وجدت تيان، التي تعمل الآن في معهد ماكس بلانك فلوريدا لعلم الأعصاب في جوبيتر، فلوريدا، وفريقها استخدامًا يمكن أن يساعد في تطوير علاجات للقلق. لقد أظهروا أن المستشعر الذي يستهدف الخلايا العصبية المتأثرة بالعقار المخدر 2,5-ديميثوكسي-4-يودوأمفيتامين يمكن استخدامه لتحديد الخلايا الأخرى التي تساهم في تأثيرات الدواء في تقليل القلق لدى الفئران دون إحداث تأثيرات هلوسة.9. وكتب مؤلفو الدراسة أن هذا الاكتشاف يمكن أن يدعم تطوير المخدر المستقبلي الذي يمكن أن يكون له فوائد علاجية دون آثار جانبية محيرة للعقل.
إشارات مختلطة
ومع ذلك، فإن أجهزة الاستشعار المشفرة وراثيا لديها بعض التحذيرات الهامة.
أحد الاعتبارات الرئيسية هو كيفية تأثير هذه البروتينات على بيولوجيا الخلايا التي يتم التعبير عنها فيها. كما هو الحال مع معظم البروتينات، يمكن أن يكون التعبير المفرط سامًا للخلايا العصبية، لذا فإن تحديد أفضل تركيز لاستخدام المستشعر هو أمر بالغ الأهمية، كما يقول تريتش. “مع كل دفعة، نحتاج إلى معرفة الكمية التي يجب تخفيفها حتى نتمكن من رؤيتها، ولكن ليس كثيرًا مما يؤدي إلى قتل الخلايا العصبية.”
لماذا يحدث هذا هو سؤال مفتوح، لكن تريتش وآخرون يقترحون احتمالين: يمكن أن تقوم بروتينات GPCR بسحب الجزيئات المطلوبة لأداء الخلايا العصبية السليمة، أو أن الإفراط في التعبير عنها يمكن أن يؤدي إلى الإفراط في توسيع الآلية الخلوية اللازمة لبناء هذه الجزيئات وتوصيلها إلى الغشاء.
نشر لأول مرة على: www.nature.com
تاريخ النشر: 2025-11-11 02:00:00
الكاتب: Diana Kwon
تنويه من موقع “yalebnan.org”:
تم جلب هذا المحتوى بشكل آلي من المصدر:
www.nature.com
بتاريخ: 2025-11-11 02:00:00.
الآراء والمعلومات الواردة في هذا المقال لا تعبر بالضرورة عن رأي موقع “yalebnan.org”، والمسؤولية الكاملة تقع على عاتق المصدر الأصلي.
ملاحظة: قد يتم استخدام الترجمة الآلية في بعض الأحيان لتوفير هذا المحتوى.